薬物治療の標的分子を解明し、病気の治癒やQOLの改善を目指します。
分子薬物治療学研究室
研究概要Research
① 抗がん薬等の最適な薬物治療を目指した研究
抗がん薬は、がんを治療するための医薬品ですが、他の薬と比べて副作用の頻度が高いこと、ないしは、強い副作用が出ることが知られています。このような副作用の原因を解明し、できるだけ少なくすることができれば、がんと戦う患者さんの助けになると考えられます。
そのような研究例の一つに、腎機能の低下した患者さんで抗がん薬イリノテカン塩酸塩を投与された際に見られた白血球減少(骨髄抑制)の原因解明があります。腎障害では、腎臓から消失する薬の体内動態が大きく変化し、薬が体内にたまりやすくなることが知られています。なぜなら、腎障害時にはそのような薬が、腎機能の低下によって、尿へ出づらくなるからです。一方、イリノテカン塩酸塩やその活性代謝物(イリノテカン塩酸塩が体内で変換して出来た抗がん作用の活性本体)SN-38は、腎臓ではなく主に肝臓で消失する薬です。にもかかわらず、腎障害患者においては、特にSN-38が投与後体内に長く残存しており、このことが副作用の一因であると考えられました。肝臓から消えるはずの薬がなぜ、腎臓の障害時に体内に蓄積するのか、私たちは患者検体やヒト肝細胞を用いた解析を進め、いくつかのメカニズムを明らかにしてきました(図5)。その結果、腎臓が障害を受けたことによって、腎臓が正常な時には尿へ流れていた尿毒症物質と呼ばれる種々の化合物が、体内に蓄積し、これらが肝臓に運ばれ、肝臓の細胞膜に存在する膜輸送体OATPs
(Organic Anion Transporting Polypeptides)の機能を低下させたり、存在する量そのものを下げたりすることが分かりました。さらに、尿毒症物質は血液中のタンパク質と強固に結合するため、SN-38が血液中でタンパク質と結合する割合も低下させていました(図5)。
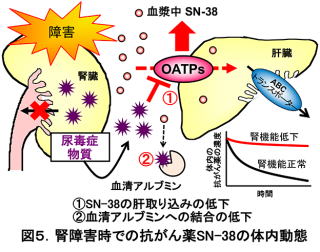
このようなSN-38の血液中でのタンパク結合率の変化は、 SN-38による副作用と直接関連する非結合形SN-38濃度(タンパクに結合していないSN-38の濃度)は変化させませんが、トータルのSN-38濃度(タンパクに結合したものと結合していないものの和)を減少させる方向に働くため、患者で見られる血中非結合形濃度の増加を過小評価してしまう(危険性が低いと判断してしまう)危険性のあることも患者検体を使って実証しました。また、どのくらいの投与量を投与すれば、腎障害時でも腎正常時と同程度のレベルのSN-38体内濃度が得られるかについても、患者におけるイリノテカン塩酸塩とSN-38の体内動態を記述する数理モデル(生理学的速度論モデル:PBPK
model)を構築することで、突き止めることもできました。
もう一つの例として、大腸がんなどに用いられている抗がん薬レゴラフェニブと活性代謝物の皮膚毒性の研究があります。レゴラフェニブは体内で活性代謝物M-2ついでM-5に変換され、これら3つの化合物すべてに抗がん作用があります。臨床で抗腫瘍効果を示す反面、皮膚障害の副作用が知られています。私たちはその原因の解明を目指し、マウスとヒト膜輸送体導入細胞を用いた研究を行っています。これまでの私たちの検討結果では、M-2とM-5の主な消失臓器である肝臓における消失に、膜輸送体であるP-糖タンパク質(P-gp)とbreast cancer resistance protein(BCRP)が関与することが分かりました(図6)。
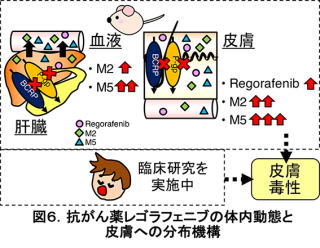
さらに、私たちの以前の研究から、これら膜輸送体がヒトやマウスの皮膚にも存在し、機能していることを突き止めていましたので、皮膚での役割についても解明を進めたところ、レゴラフェニブ、M-2、M-5のすべての化合物の皮膚から血液中への汲み出しにこれら2つの膜輸送体が関係することが分かりました(図6)。とくに、活性代謝物M-5の皮膚への分布に対する働きは極めて大きく、皮膚毒性との関連を明らかにしていく必要があります。以上の結果をもとに、現在、患者さんを対象とした臨床研究を行い、これら膜輸送体も含め、副作用に関連する因子の解明を目指しています。関連因子を明らかにすることで、安全な薬物治療に貢献したいと考えています。
<このテーマに関連する主な研究業績>
Masuo Y, Fujita K, Mishiro K, Seba N, Kogi T, Okumura H, Matsumoto N, Kunishima M, and KATO Y. 6-Hydroxyindole is an endogenous long-lasting OATP1B1 inhibitor elevated in renal failure patients. Drug Metab Pharmacokinet 35(6): 555-562, 2020.
Kubota Y, Fujita K, Takahashi T, Sunakawa Y, Ishida H, Hamada K, Ichikawa
W, Tsunoda T, Shimada K, Masuo Y, Kato Y, and Sasaki Y. Higher systemic
exposure to unbound active metabolites of regorafenib is associated with
short progression-free survival in colorectal cancer patients. Clin Pharmacol Ther 108(3): 586-595, 2020.
Iwase M, Fujita K, Nishimura Y, Seba N, Masuo Y, Ishida H, Kato Y, Kiuchi
Y. Pazopanib interacts with irinotecan by inhibiting UGT1A1-mediated glucuronidation,
but not OATP1B1-mediated hepatic uptake, of an active metabolite SN-38.
Cancer Chemother Pharmacol 83(5): 993-998, 2019.
Kawanishi T, Arakawa H, Masuo Y, Nakamichi N, Kato Y. Bile duct obstruction
leads to increased intestinal expression of breast cancer resistance protein
with reduced gastrointestinal absorption of imatinib. J Pharm Sci 108(9): 3130-3137, 2019.
Al-Shammari AH, Masuo Y, Fujita K, Yoshikawa Y, Nakamichi N, Kubota Y, Sasaki Y, Kato Y. Influx and efflux transporters contribute to the increased dermal exposure to active metabolite of regorafenib after repeated oral administration. J Pharm Sci 108(6): 2173-2179, 2019.
Ellawatty WEA, Masuo Y, Fujita KI, Yamazaki E, Ishida H, Arakawa H, Nakamichi
N, Abdelwahed R, Sasaki Y, Kato Y. Organic Cation Transporter 1 Is Responsible
for Hepatocellular Uptake of the Tyrosine Kinase Inhibitor Pazopanib. Drug Metab Dispos 46(1): 33-40, 2018.
Fujita K, Masuo Y, Yamazaki E, Shibutani T, Kubota Y, Nakamichi N, Sasaki Y, Kato Y. Involvement of the transporters P-gp and BCRP in dermal distribution of the multi-kinase inhibitor regorafenib and its active metabolites. J Pharm Sci 106(9): 2632-2641, 2017.
Fujita K, Masuo Y, Okumura H, Watanabe Y, Suzuki H, Sunakawa Y, Shimada
K, Kawara K, Akiyama Y, Kitamura M, Kunishima M, Sasaki Y, Kato Y. Increased
plasma concentrations of unbound SN-38, the active metabolite of irinotecan,
in cancer patients with severe renal failure. Pharm Res 33(2): 269-282, 2016.
Fujita K, Sugiura T, Okumura H, Umeda S, Nakamichi N, Watanabe Y, Suzuki
H, Sunakawa Y, Shimada K, Kawara K, Sasaki Y and Kato Y. Direct inhibition
and down-regulation by uremic plasma components of hepatic uptake transporter
for SN-38, an active metabolite of irinotecan, in humans. Pharm Res 31: 204-215, 2014.
⑤ 生理活性タンパク質の体内動態とアンメット疾患への応用
詳細は、こちら。
