薬物治療の標的分子を解明し、病気の治癒やQOLの改善を目指します。
分子薬物治療学研究室
研究概要Research
④ 培養細胞系と数理モデルによるヒト薬物動態・効果の予測
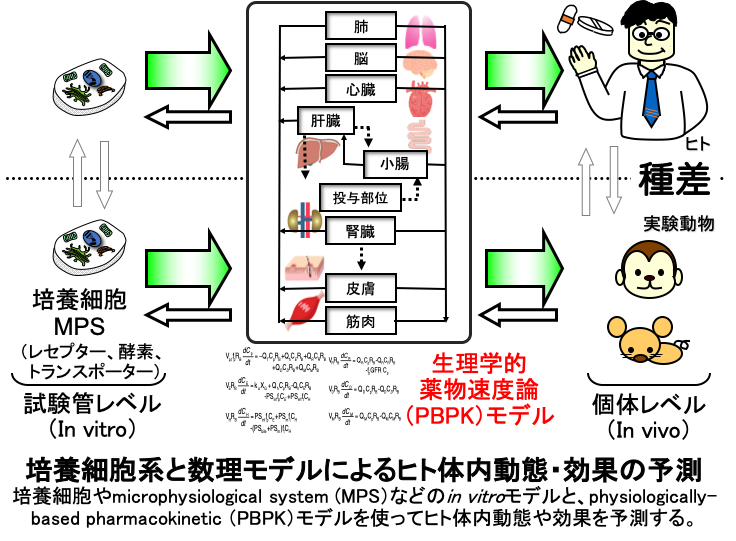
医薬品開発においては、ヒトに投与する前に医薬品候補となる化合物のヒトでの体内動態や効果を予測する必要があります。その化合物に効果があるかどうかは、まずは実験動物を用いて評価しますが、薬物動態は動物とヒトとの間に大きな種差があるため、動物での薬物動態をそのままヒトに換算することは極めて困難です。そのため、ヒト由来の細胞系(in vitro試験)を用いた動態解析を平行して行うことになりますが、その場合、in vitroとヒト個体レベル(in vivo)との間にも大きな隔たりがありますので、適切な数理モデルを用いる必要があります。私たちの研究室では、この細胞系と数理モデルの両方をヒトの予測にとって適切なものに最適化する試みを続けています。前者については、最近、microphysiological system(MPS)と呼ばれる個体レベルの生理的環境下に近い細胞培養系が開発されていますので、最先端のMPS研究者との共同研究を行い、適切な数理モデルを構築して、これまでの培養系では予測できなかったこと、具体的には、薬物の逐次代謝(薬物が体内で代謝物に変換され、その代謝物がさらに別の代謝物に変換されること)、その時に観察される薬物と代謝物の体内への曝露の比率、さらにはヒト個体レベルにより近づいた高いレベルの薬物代謝活性がある程度定量的に再現できることを報告しました。また、ヒト肝臓への多くの薬物の取り込みに働くトランスポーターOATP1B1は、一部の薬物によって時間依存的に抑制されることが知られていましたが、これをさらに多くの薬物に対して調査するとともに、培養細胞系で予測する数理モデルについても提唱しています。
一方で、市販後の医薬品に対しても、その安全性を確かめるための数理モデルを使った研究を製薬企業の研究者と共同で行っています。2型糖尿病の治療薬リナグリプチンは、ヒトにおいて投与量と体内への曝露が比例しない現象(非線形と呼びます)が見られます。この原因は、リナグリプチンが標的としている生体内の酵素であるDPP-4に対してリナグリプチンが高い親和性で結合することによる結合飽和によって説明できることを、生理学的薬物速度論モデル(physiologically-based pharmacokinetic, PBPK model)を使って証明しました。薬物動態で見られた特殊な現象について、なぜそのような現象が見られたのかを科学的に証明することは、その薬を安全に投与する上では極めて重要なことです。私たちの数理モデルを用いた解析は、まさにその薬が効果を示しているからこそ非線形という現象が見えたことを科学的に裏付けることができました。
<このテーマに関連する主な研究業績>
Taguchi T, Masuo Y, Futatsugi A, Kato Y. Static model-based assessment
of OATP1B1-mediated drug interactions with preincubation-dependent inhibitors
based on inactivation and recovery kinetics. Drug Metab Dispos 48(9): 750-758, 2020.
Sarashina A, Chiba K, Tatami S, Kato Y. Physiologically based pharmacokinetic
model of the DPP-4 inhibitor linagliptin to describe its nonlinear pharmacokinetics
in humans. J Pharm Sci 109(7): 2336-2344, 2020.
Arakawa H, Sugiura S, Kawanishi T, Shin K, Toyoda H, Satoh T, Sakai Y,
Kanamori T, Kato Y. Kinetic analysis of sequential metabolism of triazolam
and its extrapolation to humans using an entero-hepatic two-organ microphysiological
system. Lab on a Chip 20(3): 537-547, 2020.
Taguchi T, Masuo Y, Sakai Y, Kato Y. Short-lasting inhibition of hepatic
uptake transporter OATP1B1 by tyrosine kinase inhibitor pazopanib. Drug Metab Pharmacokinet 34(6): 372-379, 2019.
Taguchi T, Masuo Y, Kogi T, Nakamichi N, Kato Y. Characterization of long-lasting
Oatp inhibition by typical inhibitor cyclosporine A and in vitro-in vivo
discrepancy in its drug interaction potential in rats. J Pharm Sci 105(7): 2231-2239, 2016.
Takeuchi K, Sugiura T, Matsubara K, Sato R, Shimizu T, Masuo Y, Horikawa
M, Nakamichi N, Ishiwata N and Kato Y. Interaction of novel platelet-increasing
agent eltrombopag with rosuvastatin via breast cancer resistance protein
in human. Drug Metab Dispos 42: 726-734, 2014.
Takeuchi K, Sugiura T, Umeda S, Matsubara K, Horikawa M, Nakamichi N, Silver DL, Ishiwata N, Kato Y. Pharmacokinetics and hepatic uptake of eltrombopag, a novel platelet-Increasing agent. Drug Metab Dispos 39(6): 1088-1096, 2011.
① 抗がん薬等の最適な薬物治療を目指した研究
詳細は、こちら。
② 食品由来機能性分子による神経新生作用と記憶学習の向上
③ 薬物治療を評価するバイオマーカーの探索研究
詳細は、こちら。
⑤ 生理活性タンパク質の体内動態とアンメット疾患への応用
詳細は、こちら。
