ヌクレオチド除去修復とその周辺ネットワークのメカニズム解明とがん予防・治療への応用を目指した研究
研究の概要
我々の体は37兆個の細胞から成り、そのすべてが30億(3 x 109)塩基対から成るゲノムDNAを有しています。通常の細胞(2倍体)は、父方(精子)と母方(卵子)から受け継いだ2セットを保持しているため、ゲノムDNA中の塩基数は120億(1.2 x 1010)個にも及びます。DNAの塩基は、その並び方(塩基配列)によってタンパク質や機能性RNA(tRNA,rRNAなどのノンコーディングRNA)の設計図を保存し、娘細胞や子孫に引き継がれます。複製の際にエラーが生じたり塩基に異常が生じたりすると塩基配列が書き変わり(突然変異)、結果としてタンパク質や機能性RNAの構造や量が変化して、細胞の性質や振る舞いに影響を及ぼします。この典型的な例が「がん細胞」であり、細胞ががん化するとゲノムDNA配列は正常時と比べて大きく変化していることが知られています。
我々のゲノムDNAは、内的・外的要因により日常的に傷害を受けています。これらをDNA損傷(DNA damage)と言いますが、細胞内の活性酸素で生じる酸化型塩基損傷、S-アデノシルメチオニン等で生じるメチル化塩基損傷、天然放射性核種からの電離放射線で生じる酸化型塩基損傷やDNA鎖切断、生理的条件下でも生じる酸化的脱アミノや脱塩基に伴う損傷など、避けることのできないDNA損傷が1日に細胞当たり何十万個も生じています。さらに、太陽からの紫外線、大気中・食品中の化学物質、医療用放射線等によっても付加的にDNA損傷が生成されます。
幸い、我々の細胞は、これらの多種多様なDNA損傷を見つけ出して取り除き、元の正常なDNAに回復させる仕組みを有しています。これはDNA修復(DNA repair)機構と呼ばれ、DNA損傷のタイプに応じて働く複数の仕組み(ヌクレオチド除去修復、塩基除去修復、ミスマッチ修復、DNAクロスリンク修復、相同組換え修復、非相同末端結合修復など)が知られています。この中で代表的なものがヌクレオチド除去修復(nucleotide excision repair; NER)であり、太陽光紫外線で生じるピリミジン二量体や、嵩高い化合物(ベンゾ[a]ピレン、アフラトキシンB1、シスプラチンなど)で生じる塩基(主にプリン)付加体など、二重らせんDNAを大きく歪めるタイプのDNA損傷を対象とし、30種以上のポリペプチドが段階的、協調的に作用して修復反応を行います。試験管内のNER反応の必須因子はすでに同定され、各役割と反応の概略は理解されていますが、近年、細胞内のNER反応において様々な翻訳後修飾や未知因子の関与が次々報告され、非常に競争の激しいホットな研究領域になっています。
一方、先に紹介した様々なDNA損傷に働く多様なDNA修復機構は相互に関連し合っており、DNA損傷による細胞周期チェックポイントやアポトーシス等も含めて、「DNA損傷応答(DNA damage response; DDR)ネットワーク」と呼ばれています。つまり、個々のDNA修復機構のメカニズム解明に加えて、DDR全体のネットワークとしての包括的理解も非常に重要になっています。特に、このような概念は抗がん剤開発において近年注目されており、最近承認されたオラパリブ(ポリADPリボースポリメラーゼ阻害剤)はその代表例と言えます。
このような背景の中、我々の研究室では、ヒト細胞におけるNERメカニズムの全容解明を目指すとともに、NER(因子)と他のDDR経路との関連についても研究対象を拡げ、それらの研究成果から得た知見、ツール、手法をがんの予防や治療に活かすことを意識して研究に取り組んでいます。現在、我々が力を入れている主要な2つの研究テーマについて、以下に紹介します。
-
ケミカルバイオロジーを利用したヌクレオチド除去修復メカニズムの解明とその応用(松永)
NER反応は多段階過程からなり(下図)、試験管内の再構成実験では、DNA損傷の認識から除去までの初期過程で、XPC-RAD23B-CETN2、TFIIH、XPA、RPA、ERCC1-XPF、XPGの6つの因子(20種のポリペプチド)が必須であり、生じた一本鎖DNAギャップはDNAポリメラーゼ、RFC、PCNA、DNAリガーゼ等によって埋められて一連の反応が完了します。
近年、細胞内のNERを調節する因子や反応として、クロマチンリモデラー、ヒストン修飾、修復関連因子の翻訳後修飾(リン酸化、アセチル化、ユビキチン化、SUMO化、ポリADPリボシル化など)や量的調節、プロテアソーム系や分子シャペロンの関与などが報告されており、細胞内のNER反応は非常に高度かつ緻密に調節されていることがわかってきています。
我々は、ケミカルバイオロジーを利用してヒト細胞内のNER反応の解明を目指すプロジェクトを立ち上げ、細胞内のNER効率を簡便・迅速に測定可能なセルベースドアッセイ系を開発し(特許第5565547号)(Nishinaga et al., 2012)、様々な公的化合物ライブラリーを利用してNER阻害物質を探索・同定してきました。その中で、理化学研究所のNPDepoライブラリーから同定した化合物(以後「A6」と呼ぶ)は、ERCC1をプロテアソーム依存的に分解誘導してNERを阻害することを見出し、そのメカニズムもほぼ明らかになっています(投稿準備中)。また、アルドステロン拮抗性カリウム保持利尿薬スピロノラクトン(SP)がTFIIHのXPBサブユニットをプロテアソーム依存的に分解誘導し、NERを阻害するという現象についても(Alekseev et al., 2014)A6と並行的に解析を行い、そのメカニズムを明らかにしました(Ueda et al., 2019)。興味深いことに、2つの化合物によるNER因子分解誘導経路は類似しており、NER因子の細胞内レベル調節に関わる知見につながることを期待して、さらなる解析を行っています。
また、これらの化合物は、NERのメカニズム解析にも非常に有用であり、NER反応の多段階過程を途中でストップできるため、これを利用して各段階における中間複合体を単離・同定するプロジェクトを最近新たにスタートさせました。さらに、前述のオラパリブのように、複数のDNA修復機構が同時に破綻することで合成致死を引き起こすコンセプトを参考に、我々の見つけたNER阻害化合物をベースにDNA損傷応答ネットワークを標的とした抗がん剤の開発も試みています。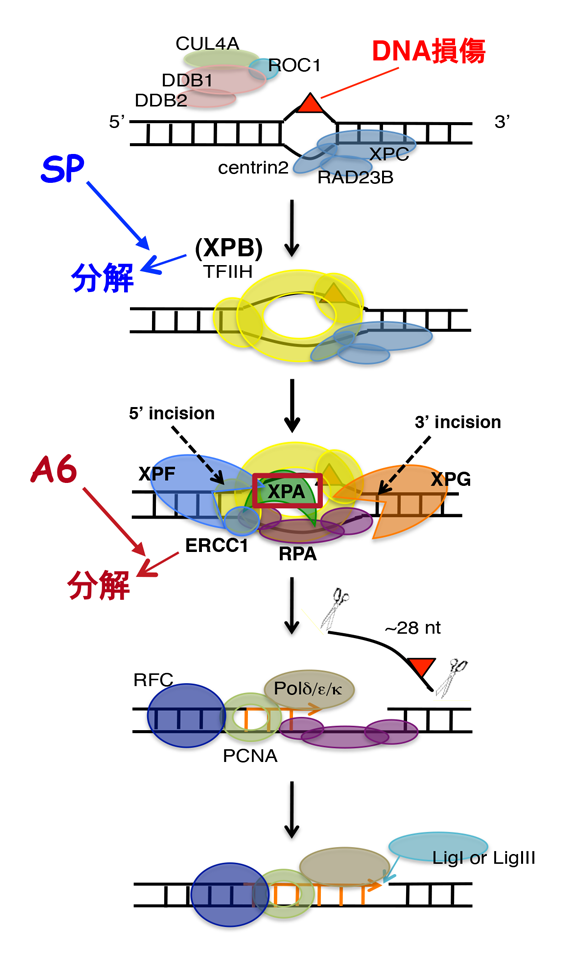
-
休止期細胞に特有のDNA損傷生成経路とその応答反応に関する研究(若杉)
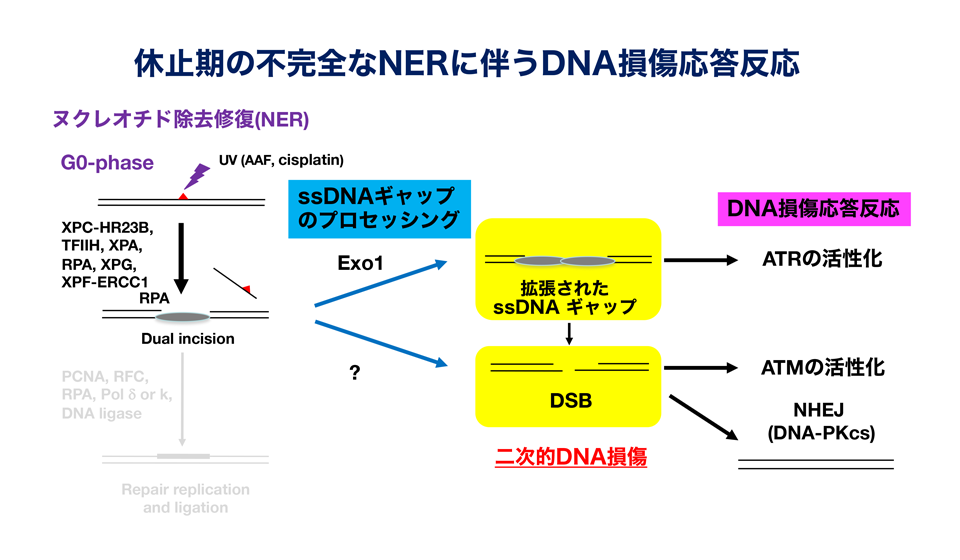
我々の体を構成する大部分の細胞は休止期もしくは休止期様の状態にありますが、DNA損傷応答研究の大部分は活発に増殖する培養細胞を用いており、休止期細胞における解析は限られています。我々は、接触増殖阻止と血清飢餓によりG0期に同調したヒト細胞で、紫外線照射後にNERによる切断反応依存的にヒストンH2AのバリアントであるH2AXがリン酸化されることを見出しました(Matsumoto et al., 2007)。この反応のメカニズムをさらに詳細に解析したところ、NERの後半の過程が不完全なために生じた一本鎖DNA(single-strand DNA; ssDNA)ギャップ中間体からssDNA領域の拡大やDNA二本鎖切断(DNA double-strand break; DSB)が生じ、DNA損傷応答経路が活性化されることがわかりました(Wakasugi et al., 2014、下図)。すなわち、生体内の休止期細胞では、紫外線もしくはNERの基質となる化学物質に暴露された後、不完全なNER反応により、リスクのより高いDNA損傷へと変換されることを意味しており、神経疾患や発癌との関連性においても非常に興味深い反応です。この過程には、エンドヌクレアーゼ等によるプロセッシングが関与すると予想しており、現在までにExo1というエキソヌクレアーゼがssDNAギャップ中間体に作用してssDNA領域を拡大することや、あるエンドヌクレアーゼがDSB生成に関わっているという結果が得られています(投稿準備中)。現在は、不完全なNERに伴う二次的DNA損傷の生成メカニズムの全容を明らかにすると共に、生じた二次的DNA損傷がもたらす生物学的意義を理解するために、上記で同定したヌクレアーゼや二次的DNA損傷の応答反応に関わる因子の欠損細胞の作製と解析、そして個体レベルでの解析も進めています。