
ワクチン・免疫科学研究室へようこそ
私たちの研究室では分子生物学的手法、免疫学的手法ならびに応用昆虫学的手法を用いて病原体の遺伝子解析およびワクチンの開発研究を行っています。特にマラリアをターゲットとした新規ワクチン開発を国内外の研究グループと連携して推進しています。
一緒に研究をしてみたいと思う学生を募集しています。興味をお持ちの方はぜひ一度見に来て下さい(大学院入試サイト)。
研究概要
ワクチン・免疫科学研究室は、国内大学の薬学系研究機関では類を見ない感染症に対する次世代ワクチン開発研究をメインテーマとして掲げています。特に、マラリア原虫の生物学、感染免疫学等の分子細胞レベルの基礎研究からワクチン・創薬開発の生体レベルの研究までを立案・推進し、その研究成果を社会に還元することを最終目的としております。生物系薬学の新規学術領域の研究室で、「斬新な薬学領域の開拓」という趣旨のもと研究を展開しています。
【研究テーマ】
 1. マラリア感染防御ワクチンの開発
1. マラリア感染防御ワクチンの開発
2. マラリア伝播阻止ワクチンの開発
3. 点鼻粘膜免疫が効果的な次世代ワクチンの開発
4. 蚊唾液タンパクを用いた抗血小板薬の創薬研究
5. 抗唾液抗体価をバイオマーカーとしたマラリアベクターコントロールの評価法開発
6. 肝臓特異的遺伝子治療用ベクターの開発
7. bispecific single-chain antibody fragmentの抗マラリア薬剤効果
8. トランスジェニック蚊を用いたマラリア原虫—蚊唾液腺の相互作用の解析
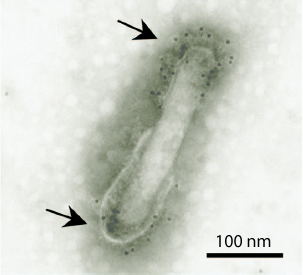 (1)マラリア感染防御ワクチンの開発:私たちは、哺乳類に非感染性のバキュロウイルス(昆虫ウイルス)をワクチンベクタープラットフォーム (Baculovirus-based vaccine: BBV)とした次世代ワクチンの研究開発を行っています。現在までにBBVエンベロープ上にマラリア原虫抗原タンパクを提示したワクチンを開発し、マウスモデルでマラリア原虫に対して100%の感染防御を達成しています。BBVは約400nmのナノパーティクルワクチンで特有の免疫賦活化効果があり、しかもヒトに感染しないという安全面でも大きなメリットをもったワクチンベクターです(右図/矢印の斑点がマラリア抗原を示す)。現在、製薬メーカーと共同で熱帯熱マラリア原虫に対するヒト用BBVワクチンを開発し、臨床応用を本気で考えています。
(1)マラリア感染防御ワクチンの開発:私たちは、哺乳類に非感染性のバキュロウイルス(昆虫ウイルス)をワクチンベクタープラットフォーム (Baculovirus-based vaccine: BBV)とした次世代ワクチンの研究開発を行っています。現在までにBBVエンベロープ上にマラリア原虫抗原タンパクを提示したワクチンを開発し、マウスモデルでマラリア原虫に対して100%の感染防御を達成しています。BBVは約400nmのナノパーティクルワクチンで特有の免疫賦活化効果があり、しかもヒトに感染しないという安全面でも大きなメリットをもったワクチンベクターです(右図/矢印の斑点がマラリア抗原を示す)。現在、製薬メーカーと共同で熱帯熱マラリア原虫に対するヒト用BBVワクチンを開発し、臨床応用を本気で考えています。
Yoshida S, Kawasaki M, Hariguchi N, Hirota K, Matsumoto M.
A baculovirus dual expression system-based malaria vaccine induces strong protection against Plasmodium berghei sporozoite challenge in mice.
Infect Immun 77:1782-9, 2009.
Yoshida S, Kondoh D, Arai E, Matsuoka H, Seki C, Tanaka T, Okada M, Ishii A.:
Baculovirus virions displaying Plasmodium berghei circumsporozoite protein protects mice against malaria sporozoite infection.
Virology 316: 161-70, 2003.
国際特許PTC/JP2007/51295号「Novel vaccine vector」(2007) Yoshida et al.
(2)マラリア伝播阻止ワクチンの開発:マラリア伝播阻止ワクチンは蚊の中に移行したマラリア原虫の受精やオオキネート/オオシストの形成を阻止することを目的としたワクチンです。BBVを用いたマラリア伝播阻止ワクチンを接種したマウスをマラリアに感染させた後、このマウスを吸血した蚊の中腸内を調べてみたところ、マラリア原虫(オオシスト)数が激減していることが確認されました。本ワクチンはマラリア流行地域において、コミュニティー全体をマラリア感染から守り、さらなる感染の拡大を防ぐワクチンとして期待されます。上記(1)の感染防御ワクチンとの組合わせにより、個人とコミュニティーの両方を守るより効果的なマラリアワクチンとして期待されます。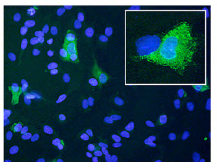
Mlambo G, Kumar N, Yoshida S.
Functional immunogenicity of baculovirus expressing Pfs25, a human malaria transmission-blocking vaccine candidate antigen.
Vaccine 28:7025-9, 2011.
Blagborough AM, Yoshida S, Sattabongkot J, Tsuboi T, Sinden RE.
Intranasal and intramuscular immunization with Baculovirus Dual Expression System-based Pvs25 vaccine substantially blocks Plasmodium vivax transmission.
Vaccine 28:6014-20, 2010.
(3)点鼻粘膜免疫が効果的な非侵襲性次世代ワクチンの開発: マラリア感染地域では、注射器不要の簡便で安全な点鼻ワクチンの開発が望まれています。私たちはBBVマラリアワクチンを点鼻接種したマウスではマラリア感染を100%防御することを見出しています。点鼻接種が局所粘膜免疫に留まらず、全身性のマラリア感染に対して感染防御免疫を誘導することは、注射器不要の簡便で非侵襲性のワクチンプラットフォームの開発につながると期待しています。私たちは、このBBV点鼻BDESワクチンのメカニズムを解明することが臨床応用に向けて極めて重要な一歩であると考えています。
Yoshida S, Nagumo H, Yokomine T, Araki H, Suzuki A, Matsuoka H.
Plasmodium berghei circumvents immune responses induced by merozoite surface protein 1- and apical membrane antigen 1-based vaccines.
PLoS One 5:e13727, 2010.
Yoshida S, Araki H, Yokomine T.
Baculovirus-based nasal drop vaccine confers complete protection against malaria by natural boosting of vaccine-induced antibodies in mice.
Infect Immun 78:595-602, 2009.
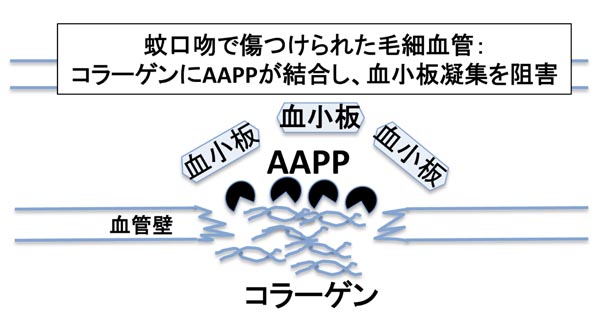 (4)蚊唾液タンパクを用いた抗血小板薬の創薬研究: 蚊の唾液中には抗血小板凝固因子、血管拡張因子等々が含まれていることは知られていますが、個々の多くの分子については解明されていません。私たちはマラリア媒介蚊であるハマダラカの唾液よりコラーゲン刺激性の血小板凝集を強力に抑制するタンパク分子AAPP (Anopheline Anti-Platelete Protein)を発見しました。今までに知られている天然物の中で最も強い血小板凝集阻害活性を有しています。AAPPは抗血小板薬としての薬効のほかに、既存の抗血小板薬の副作用である出血助長がありません。現在、製薬メーカーと共同で新規の抗血栓薬としての開発を目指しており、血栓症の予防や治療に大きく貢献できるものと期待しています。
(4)蚊唾液タンパクを用いた抗血小板薬の創薬研究: 蚊の唾液中には抗血小板凝固因子、血管拡張因子等々が含まれていることは知られていますが、個々の多くの分子については解明されていません。私たちはマラリア媒介蚊であるハマダラカの唾液よりコラーゲン刺激性の血小板凝集を強力に抑制するタンパク分子AAPP (Anopheline Anti-Platelete Protein)を発見しました。今までに知られている天然物の中で最も強い血小板凝集阻害活性を有しています。AAPPは抗血小板薬としての薬効のほかに、既存の抗血小板薬の副作用である出血助長がありません。現在、製薬メーカーと共同で新規の抗血栓薬としての開発を目指しており、血栓症の予防や治療に大きく貢献できるものと期待しています。
Hayashi H, Kyushiki H, Nagano K, Sudo T, Iyori M, Matsuoka H, Yoshida S.
Identification of the active region responsible for the anti-thrombotic activity of anopheline anti-platelet protein from a malaria vector mosquito.
Platelets in press, 2012.
Hayashi H, Kyushiki H, Nagano K, Sudo T, Matsuoka H, Yoshida S.
Anopheline anti-platelet protein from a malaria vector mosquito has anti-thrombotic effects in vivo without compromising hemostasis.
Thromb Res 129(2):169-75, 2012.
Yoshida S, Sudo T, Niimi M, Tao L, Sun B, Kambayashi J, Watanabe H, Enjou L, Matsuoka H.
Inhibition of collagen-induced platelet aggregation by anopheline anti-platelet protein, a saliva protein from a malaria vector mosquito.
Blood 111:2007-14, 2008.
国際特許PCT/JP2006/322417号「Anti-Platelet Aggregation Product」 (2006) Yoshida et al.
(5)抗唾液抗体価をバイオマーカーとしたマラリアベクターコントロールの評価法開発: マラリア感染地域では、多くのマラリア対策が同時に進行しています。マラリア媒介蚊対策である殺虫剤含有の蚊帳(ITNs)や忌避剤(SR)の効果はマラリア感染率低下と吸血頻度減少で評価されますが、同時進行の別の対策との効果比較を行う確立された方法はありません。さらにITNsやSRを家々で適切に使用していることを前提としており不確かな要素が存在しています。このため、マラリア対策の有効性を正確に評価する新たな「マラリア感染危険度」のクライテリアの設定が望まれています。私たちは、マラリア感染地域住民の血液には上記(4)のAAPPに対する抗体が高頻度で検出され、しかもマラリア感染経験(回数)と密接にリンクしていることを見出しています。現在インドネシアの研究グループと共同でAAPP抗体価測定によるマラリア疫学調査の新システムを開発することを目指しています。世界のマラリアベクターコントロールの推進およびマラリアアウトブレイクを未然に防ぐ非常に重要で意義深い研究となると期待されます。
(6)肝臓特異的遺伝子治療用ベクターの開発:私たちはマラリア研究からヒントを得て、肝臓特異的な遺伝子導入ベクターの開発研究を行っています。マラリア原虫が蚊の吸血によりヒト体内に注入されると、血流に乗り肝臓に到達し、肝細胞に特異的に侵入します。この特異性に着目し、肝臓特異的遺伝子導入ベクターの開発を行っています。将来的には血友病、肝臓ガン、代謝異常症等の肝疾患に対して新たな治療方法を提供することが期待されます。
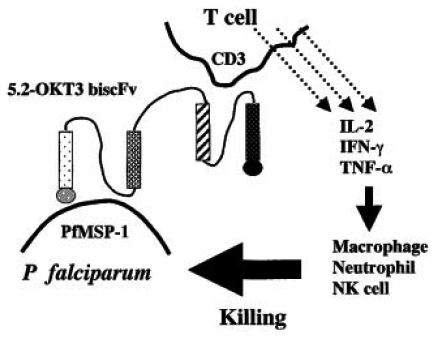 (7)bispecific single-chain antibody fragmentの抗マラリア薬剤効果:OKT3はヒトCD3複合体のεサブユニット上のエピトープと反応するモノクローナル抗体です。一方、5.2モノクローナル抗体は熱帯熱マラリア原虫の19-kDaのメロゾイト抗原に反応します。私たちはそれぞれの抗体遺伝子をクローニングし単鎖抗体を作製した後、さらに両者を融合させた二重特異性単鎖抗体(bispecific single-chain antibody fragment; biscFv)の作製に成功しました(右図)。5.2-OKT3 biscFvは熱帯熱マラリア原虫メロゾイト期に特異的に結合する一方で、ヒトCD8陽性T細胞にも強い結合能があることが明らかになり、さらにメロゾイトをT細胞に凝集させる特性があることが証明されました。驚くべきことに、5.2-OKT3 biscFvでメロゾイトをT細胞に凝集させた際に、T細胞からIL-2、IFN-γならびにTNF-αといったサイトカインの産生が促されるだけではなく、貪食細胞の原虫貪食活性を増強する効果があることが分かりました。5.2-OKT3 biscFvは血内期のマラリア感染時における新規コンセプトの抗マラリア治療薬の候補になると期待されます。
(7)bispecific single-chain antibody fragmentの抗マラリア薬剤効果:OKT3はヒトCD3複合体のεサブユニット上のエピトープと反応するモノクローナル抗体です。一方、5.2モノクローナル抗体は熱帯熱マラリア原虫の19-kDaのメロゾイト抗原に反応します。私たちはそれぞれの抗体遺伝子をクローニングし単鎖抗体を作製した後、さらに両者を融合させた二重特異性単鎖抗体(bispecific single-chain antibody fragment; biscFv)の作製に成功しました(右図)。5.2-OKT3 biscFvは熱帯熱マラリア原虫メロゾイト期に特異的に結合する一方で、ヒトCD8陽性T細胞にも強い結合能があることが明らかになり、さらにメロゾイトをT細胞に凝集させる特性があることが証明されました。驚くべきことに、5.2-OKT3 biscFvでメロゾイトをT細胞に凝集させた際に、T細胞からIL-2、IFN-γならびにTNF-αといったサイトカインの産生が促されるだけではなく、貪食細胞の原虫貪食活性を増強する効果があることが分かりました。5.2-OKT3 biscFvは血内期のマラリア感染時における新規コンセプトの抗マラリア治療薬の候補になると期待されます。
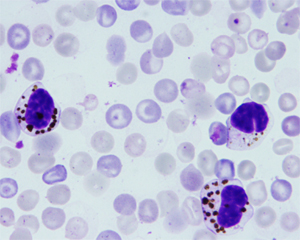 右図:5.2-OKT3 biscFvによる原虫貪食活性の増強
右図:5.2-OKT3 biscFvによる原虫貪食活性の増強
Yoshida S, Kobayshi T, Matsuoka H, Seki C, Gosnell WL, Chang SP, Ishii A.
T cell activation and cytokine production via a bispecific single-chain antibody fragment targeted to blood-stage malaria parasites.
Blood 101: 2300-2306, 2003.
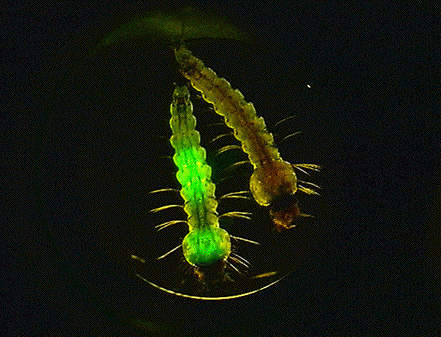
(8)トランスジェニック蚊を用いたマラリア原虫—蚊唾液腺の相互作用の解明:ハマダラカ唾液腺はマラリア原虫のスポロゾイトが集積する重要な器官であり、吸血により唾液とともにマラリア原虫が宿主へ侵入するいわば蚊のステージのマラリア原虫の最終居住地です。しかし、マラリア原虫のライフサイクルの中でもその唾液腺侵入メカニズム、関与する分子については解明が進んでいません。一体、数万匹にも及ぶスポロゾイトが何時、何処に、どのようにして唾液腺に侵入していくのかという謎を独自に開発した唾液腺トランスジェニック (TG)蚊技術を駆使し解明することを目指しています。私たちはハマダラカ卵にマイクロインジェクションして、TG蚊を作製する技術を確立しています。この技術を用いて唾液腺に外来タンパクを発現するTG蚊の作製を世界に先駆けて成功しました。すでに異なる遺伝子を唾液腺に発現する5系統のTG蚊を作製しています。
 右図:トランスジェニックハマダラカ
右図:トランスジェニックハマダラカ
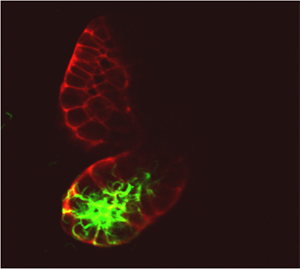 左図:DsRed発現型ハマダラカ唾液腺におけるEGFP発現マラリア原虫
左図:DsRed発現型ハマダラカ唾液腺におけるEGFP発現マラリア原虫
Sumitani M, Kasashima K, Yamamoto DS, Yagi K, Yuda M, Matsuoka H, Yoshida S.
Reduction of malaria transmission by transgenic mosquitoes expressing an antisporozoite antibody in their salivary glands.
Insect Mol Biol In press, 2012.
Yamamoto DS, Sumitani M, Nagumo H, Yoshida S, Matsuoka H.
Induction of antisporozoite antibodies by biting of transgenic Anopheles stephensi delivering malarial antigen via blood feeding.
Insect Mol Biol 21:223, 2012.
Yamamoto DS, Nagumo H, Yoshida S.
Induction of antisporozoite antibodies by biting of transgenic Anopheles stephensi delivering malarial antigen via blood feeding.
Insect Mol Biol 19:391, 2010.
Yoshida S, Shimada Y, Kondoh D, Kouzuma Y, Ghosh AK, Jacobs-Lorena M, Sinden RE.
Hemolytic C-type lectin CEL-III from sea cucumber expressed in transgenic mosquitoes impairs malaria parasite development.
PLoS Pathogen 3:e192, 2007.
Yoshida S & Watanabe H.
Robust salivary gland-specific transgene expression in Anopheles stephensi mosquito.
Insect Mol Biol 15:403-10, 2006.
Copyright© Laboratory of Vaccinology and Applied Immunology, Kanazawa University, 2011-2021.
金沢大学医薬保健研究域薬学系 ワクチン・免疫科学研究室
     |